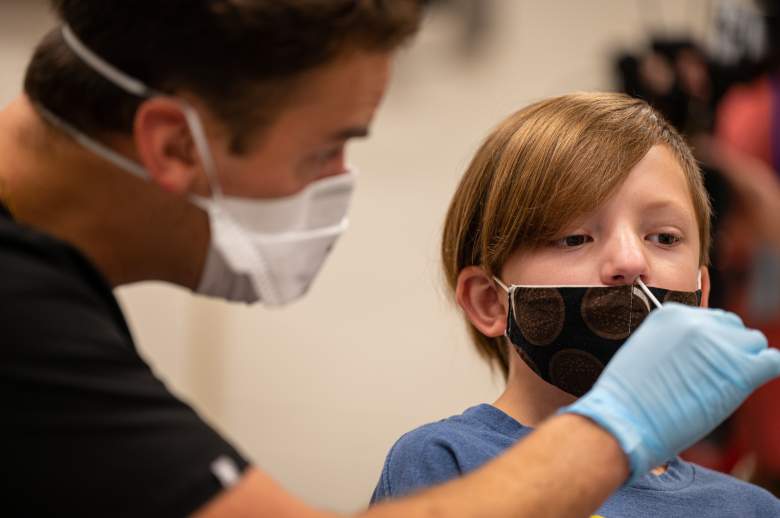
Al principio de la pandemia del COVID, los datos mostraban que era muy extraño que los niños se enfermaran con el coronavirus, pero a medida que han pasado los meses, informes médicos han dejado ver que los pequeños también están expuestos, aunque no al nivel de adultos vulnerables, por lo que urgen no bajar la guardia y seguir adoptando medidas para protegerlos.
Ese es el llamado que está haciendo la FDA (Administración de Alimentos y Medicamentos de los Estados Unidos), tras advertir que justo cuando los niños están regresando a las escuelas a tomar clases presenciales, hay que redoblar esfuerzos, sobretodo con aquellos menores que aun no califican para vacunarse.
La FDA urgió a los adultos a que sigan al pie de la letra recomendaciones y protocolos básicos de seguridad, que garanticen que los menores no se vayan a contagiar de COVID, entre ellos la vacunación de adultos.
“Hasta que autoricemos o aprobemos una vacuna para esta población de niños pequeños, es especialmente importante que los padres y otras personas que interactúan cercanamente con niños menores de 12 años se vacunen, usen mascarillas y sigan otras precauciones recomendadas para que podamos proteger a quienes aún no pueden protegerse a sí mismos mediante la vacunación”, dijeron en un comunicado conjunto, la comisionada interina de la FDA, la doctora Janet Woodcock, y el doctor Peter Marks, director del Centro de Investigación y Evaluación de Productos Biológicos de la FDA.
Los funcionarios federales también admitieron que hay mucha ansiedad entre padres de familia por conocer cuándo se aprobará la vacuna contra el COVID para menores de 12 años, y explicaron en qué va ese proceso.
“Sabemos que ha habido preguntas y comentarios públicos sobre el proceso en torno a las vacunas para niños pequeños, por lo que creemos que es importante compartir información sobre el proceso y las consideraciones necesarias involucradas para brindar mayor claridad al público sobre este importante esfuerzo”, dijeron los jefes de la FDA en su misiva.
“Es importante que el público reconozca que debido a que los niños pequeños aún están creciendo y desarrollándose, es fundamental que se completen ensayos clínicos exhaustivos y sólidos de tamaño adecuado para evaluar la seguridad y la respuesta inmune a una vacuna contra el COVID-19 en esa población. Los niños no son adultos pequeños, y hay asuntos que pueden abordarse durante los ensayos de las vacunas pediátricas, y éstos pueden incluir si existe la necesidad de diferentes dosis o formulaciones de diferentes concentraciones de las vacunas que ya se usan para adultos”, explicaron en el comunicado.
La FDA también hizo referencia a las medidas que tomarán para garantizar la seguridad y eficacia de las vacunas en niños pequeños y aseguraron:
“Primero, los fabricantes de las vacunas han informado que se están llevando a cabo los ensayos clínicos necesarios que involucran a niños como participantes. Algunos han declarado que todavía los están inscribiendo y algunos todavía están administrando dosis o siguiendo a los participantes. Se espera que este proceso incluya por lo mínimo un período de seguimiento de aproximadamente dos meses para detectar posibles eventos de seguridad después de la administración de las dosis de la vacuna.
Una vez que los fabricantes completen la parte relevante de sus ensayos clínicos, los fabricantes deben terminar el análisis de los datos de los estudios para comprender qué tan segura es la vacuna y qué tan efectiva es en los participantes del ensayo clínico. La FDA trabajará en estrecha colaboración con cada fabricante para garantizar que este análisis de datos sea sólido y cumpla con los estándares regulatorios. Después de que los fabricantes analicen los datos de sus ensayos clínicos, recopilarán la información y podrán solicitar una autorización de uso de emergencia (EUA, por sus siglas en inglés) o presentar una solicitud de licencia de biológicos para aprobación, según corresponda, para este grupo de niños a la FDA.
Una vez que la FDA reciba una propuesta completa o solicitud, la agencia evaluará los datos de manera cuidadosa, exhaustiva e independiente para evaluar los beneficios y los riesgos y estar preparada para completar su revisión lo más rápido posible, probablemente en cuestión de semanas en lugar de meses. Sin embargo, la capacidad de la agencia para revisar estas solicitudes rápidamente dependerá en parte de la calidad y puntualidad de las propuestas de los fabricantes”.
La FDA agregó que esa agencia se encargará de asegurarse de que la dosis de la vacuna y las dosis que se usen en niños sean adecuadas, seguras y efectivas.

